José Rafael Blesa
Bases genéticas y moleculares de las enfermedades mitocondriales
Entre las enfermedades mitocondriales podemos hablar de «enfermedades de transporte» al referirnos a aquellas en las que subyace un defecto en la maquinaria de transporte mitocondrial, constituida básicamente por las translocasas TOMM (Translocase Outer Mitochondrial Membrane) y TIMM (Translocase Inner Mitochondrial Membrane) y otros complejos que participan en el importe de las proteínas mitocondriales a su destino mitocondrial. Este es el caso del síndrome de Mohr-Tranebjaerg (MTS, MIM 304700) y de otras patologías mitocondriales en las que se han identificado diversas mutaciones, tras un rastreo llevado a cabo en los últimos años en pacientes mitocondriales de base molecular desconocida, en los genes TIMM8A y MIA40, respectivamente. Por un lado, estudiamos las bases moleculares de MTS con el fin de Identificar las disfunciones mitocondriales específicas y los mecanismos que desencadenan los efectos neurodegenerativos. Así mismo, se estudia el fenotipo bioquímico y las posibles alteraciones derivadas, en un grupo de pacientes pediátricos que comparten una nueva mutación en el gen MIA40. Por otro lado, profundizamos en la regulación de la expresión génica de los genes implicados en estos procesos de transporte, más concretamente en los factores de transcripción denominados NRFs, Nuclear Respiratory Factors, que hemos identificado como coordinadores de la expresión de estos genes. En este estudio también se incluye el gen humano PNPT1, recientemente relacionado con el importe mitocondrial de ARN.
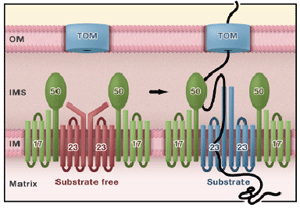
The Translocation Machinery in Mitochondria. The mitochondrial outer membrane (OM) contains the translocase of the outer membrane (TOM) that precursor proteins pass through to reach the inner membrane (IM). The translocase of the inner membrane (TIM)-23 complex contains Tim23, Tim17, and Tim50 and functions in the import of precursors to the mitochondrial matrix. In the resting state (left), when a precursor is not engaged in the translocon, Tim50 and the intermembrane space (IMS) domain of Tim23 shield the translocation channel. In a study using fluorescent probes (Alder et al., 2008b), fluorescence of the labeled resting (substrate-free) Tim23 protein is red-shifted (left). However, in the presence of a substrate that is being imported (right), the fluorescently labeled Tim23 shifts to a lower wavelength, indicating interactions with substrate and the exclusion of water molecules.
(Walsh and Koehler, 2008. Cell,134:383).
Terapia génica mitocondrial en enfermedades mitocondriales
Las enfermedades mitocondriales suelen afectar a niños y llevan a la muerte en meses o años. Entre las causas subyacentes están los defectos en la fosforilación oxidativa (OXPHOS)debidos a mutaciones en el ADN mitocondrial (ADNmt). Se pretende desarrollar nuevas estrategias para una terapia génica en enfermedades mitocondriales, enfocadas a introducir ADNmt en cíbridos de pacientes con mutaciones incapacitantes en el ADNmt. La transformación de las mitocondrias ha sido considerada un objetivo irreal, un reto inalcanzable desde la caracterización de ADNmt. El uso de sistemas de liberación sintéticos basados en nanopartículas de materiales híbridos orgánicos-inorgánicos es una metodología prometedora para arrojar luz sobre la posibilidad de transformar las mitocondrias. Otras aproximaciones también son posibles, utilizando los conocimientos adquiridos en los últimos años sobre el transporte de proteínas a mitocondrias mediante las translocasas TOMM (Translocase Outer Mitochondrial Membrane) y TIMM (Translocase Inner Mitochondrial Membrane), y más recientemente sobre el proceso de importe de ARN a la mitocondria mediante PNPASE.
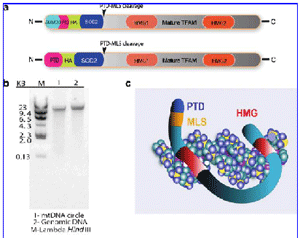 The technology “ProtoFection”. Is an approach for mitochondrial gene therapy that uses recombinant human mitochondrial transcription factor A (TFAM) engineered with an N-terminal protein transduction domain (PTD) followed by the SOD2 mitochondrial localization signal (MLS) to deliver mtDNA cargo to the mitochondria of living cells. (a) Structure of recombinant MTD–TFAM when it is initially produced with the N-terminal (6His) SUMO group (top) and after removal of the SUMO group with SUMO protease (bottom). PTD, 11-arginine protein transduction domain; HA, hemagglutinin epitope; SOD2, mitochondrial matrix localization signal (MLS) of superoxide dismutase-2; HMG, high mobility group domains; TFAM, mitochondrial transcription factor A. Arrowheads indicate location of cleavage by mitochondrial endopeptidase of MLS after importation. (b) Agarose gel electrophoresis image of Roche human genomic DNA before (lane 2) and after (lane 1) incubation with Plasmid Safe ATP-dependent exonuclease. A 200-ng amount of DNA was added to each lane. (c) Diagram of proposed binding of MTD–TFAM to mtDNA.
The technology “ProtoFection”. Is an approach for mitochondrial gene therapy that uses recombinant human mitochondrial transcription factor A (TFAM) engineered with an N-terminal protein transduction domain (PTD) followed by the SOD2 mitochondrial localization signal (MLS) to deliver mtDNA cargo to the mitochondria of living cells. (a) Structure of recombinant MTD–TFAM when it is initially produced with the N-terminal (6His) SUMO group (top) and after removal of the SUMO group with SUMO protease (bottom). PTD, 11-arginine protein transduction domain; HA, hemagglutinin epitope; SOD2, mitochondrial matrix localization signal (MLS) of superoxide dismutase-2; HMG, high mobility group domains; TFAM, mitochondrial transcription factor A. Arrowheads indicate location of cleavage by mitochondrial endopeptidase of MLS after importation. (b) Agarose gel electrophoresis image of Roche human genomic DNA before (lane 2) and after (lane 1) incubation with Plasmid Safe ATP-dependent exonuclease. A 200-ng amount of DNA was added to each lane. (c) Diagram of proposed binding of MTD–TFAM to mtDNA.
(Keeney et al., 2009. Human Gene Therapy 20:1-11)
Grupos colaboradores
Dr. Jordi Pérez Tur. Instituto de Biomedicina de Valencia (CSIC).
Línea de investigación: ANÁLISIS DEL PROMOTOR DEL GEN HUMANO LRRK2.
Dr. Julio Montoya Villaroya. Universidad de Zaragoza.
Línea de investigación: ESTABLECIMIENTO DE CÍBRIDOS EN ENFERMEDADES MITOCONDRIALES.
Dr. Joaquín Jordán Bueso. Universidad de Castilla-La Mancha.
Línea de investigación: IDENTIFICACIÓN DE RUTAS DE MUERTE CELULAR NEURONAL EN ENFERMEDADES NEURODEGENERATIVAS COMO PARKINSON Y ALZHEIMER.
Publicaciones seleccionadas
Prieto-Ruiz JA, Alis R, García-Benlloch S, Sáez-Atiénzar S, Ventura I, Hernández-Andreu JM, Hernández-Yago J, Blesa JR.
Expression of the human TIMM23 and TIMM23B genes is regulated by the GABP transcription factor.
Biochim Biophys Acta – Gene Regulatory Mechanisms 2018 Feb;1861(2):80-94
PMID: 29413900 doi: 10.1016/j.bbagrm.2018.01.006
Sara Sáez Atiénzar; Luis Bonet Ponce; José R. Blesa; Francisco J. Romero; Michael P. Murphy; Joaquín Jordán; María F. Galindo.
The LRRK2 inhibitor GSK2578215A induces protective autophagy in SH-SY5Y cells: involvement of Drp-1–mediated mitochondrial fission and mitochondrial-derivate ROS signaling.
Cell Death & Disease, 2014 Aug 14;5:e1368
10.1038/cddis.2014.320
Muniesa C, Vicente V, Quesada M, Saez S, Blesa JR, Abasolo I, Fernandez Y, Botella P.
Glutathione-sensitive nanoplatform for monitored intracellular delivery and controlled release of Camptothecin.
RSC Advances, 2013;3:15121-15131.
10.1039/C3RA41404C
Gao F, Botella P, Corma A, Blesa J, Dong L.
Monodisperser mesoporous silica nanoparticles with very large pores for enhanced adsorption and release of DNA.
Journal of Physical Chemistry B. 2009;113(6):1796-1804.
PMID: 19152258. 10.1021/jp807956r
Blesa JR, Hegde AA, Hernández-Yago J.
In vitro methylation of nuclear respiratory factor-2 binding sites suppresses the promoter activity of human TOMM70 gene.
Gene. 2008;427(1-2):58-64.
PMID: 18852034. 10.1016/j.gene.2008.09.016
Blesa JR, Prieto-Ruiz JA, Abraham BA, Harrison BL, Hegde AA, Hernández-Yago J.
NRF-1 is the major transcription factor regulating the expression of the human TOMM34 gene.
Biochemistry and Cell Biology-Biochimie et Biologie Cellulaire. 2008;86(1):46-56.
PMID: 18364745. 10.1139/O07-151
Blesa JR, Solano A, Briones P, Prieto-Ruiz JA, Hernández-Yago J, Coria F.
Molecular genetics of a patient with Mohr-Tranebjaerg syndrome due to a new mutation in the DDP1 gene.
Neuromolecular Medicine. 2007:9(4):285-291.
PMID: 17999202. 10.1007/s12017-007-8000-3
Blesa JR, Prieto-Ruiz JA, Hernandez JM, Hernández-Yago J.
NRF-2 transcription factor is required for human TOMM20 gene expression.
Gene. 2007;391(1-2):198-208.
PMID: 17300881. 10.1016/j.gene.2006.12.024
